Der Hauptunterschied zwischen Borazin und Benzol besteht darin, dass das Borazin drei Boratome und drei Stickstoffatome in der Ringstruktur enthält, während das Benzol sechs Kohlenstoffatome in der Ringstruktur aufweist.
Sowohl Borazin als auch Benzol haben ähnliche Strukturen mit einem sechsgliedrigen Ring, und diese beiden Verbindungen sind isoelektronisch. Das heißt, sowohl Borazin als auch Benzol haben die gleiche Anzahl von Elektronen oder die gleiche elektronische Struktur.
Sie haben jedoch völlig unterschiedliche chemische und physikalische Eigenschaften, weil die Ringe dieser Verbindungen aus unterschiedlichen Atomen bestehen.
Was ist Borazin?
Borazin ist eine anorganische Verbindung mit der chemischen Formel B3H6N3. Es handelt sich um eine zyklische Verbindung mit einer sechsgliedrigen Ringstruktur.
Das heißt, sie hat drei B-H-Einheiten und drei N-H-Einheiten in einem alternierenden Muster. Daher kann die chemische Formel als (BH3)(NH3) geschrieben werden. Auch diese Struktur ist isoelektronisch mit dem Benzolring.
Wie Benzol ist auch dieser Stoff bei Raumtemperatur eine farblose Flüssigkeit. Daher wird es manchmal auch als „anorganisches Benzol“ bezeichnet.
Die molare Masse von Borazin beträgt 80,50 g/mol. Der Schmelz- und Siedepunkt liegt bei -58 °C bzw. 53 °C. Außerdem hat es einen aromatischen Geruch.
Außerdem handelt es sich um eine synthetische Verbindung, die wir aus Diboran und Ammoniak im Verhältnis 1:2 herstellen können.
Die chemische Reaktion, die bei diesem Prozess abläuft, ist die folgende:
3 B2H6 + 6 NH3 → 2 B3H6N3 + 12 H2
Wenn man Borazin zu Wasser gibt, hydrolysiert es zu Borsäure, Ammoniak und Wasserstoffgas. Außerdem ist diese Verbindung aufgrund ihrer niedrigen Standardbildungsenthalpie (-531 kJ/mol) thermisch sehr stabil.
Borazin ist im Vergleich zu Benzol viel reaktiver. Es kann zum Beispiel mit Chlorwasserstoff reagieren, während Benzol dies nicht kann.
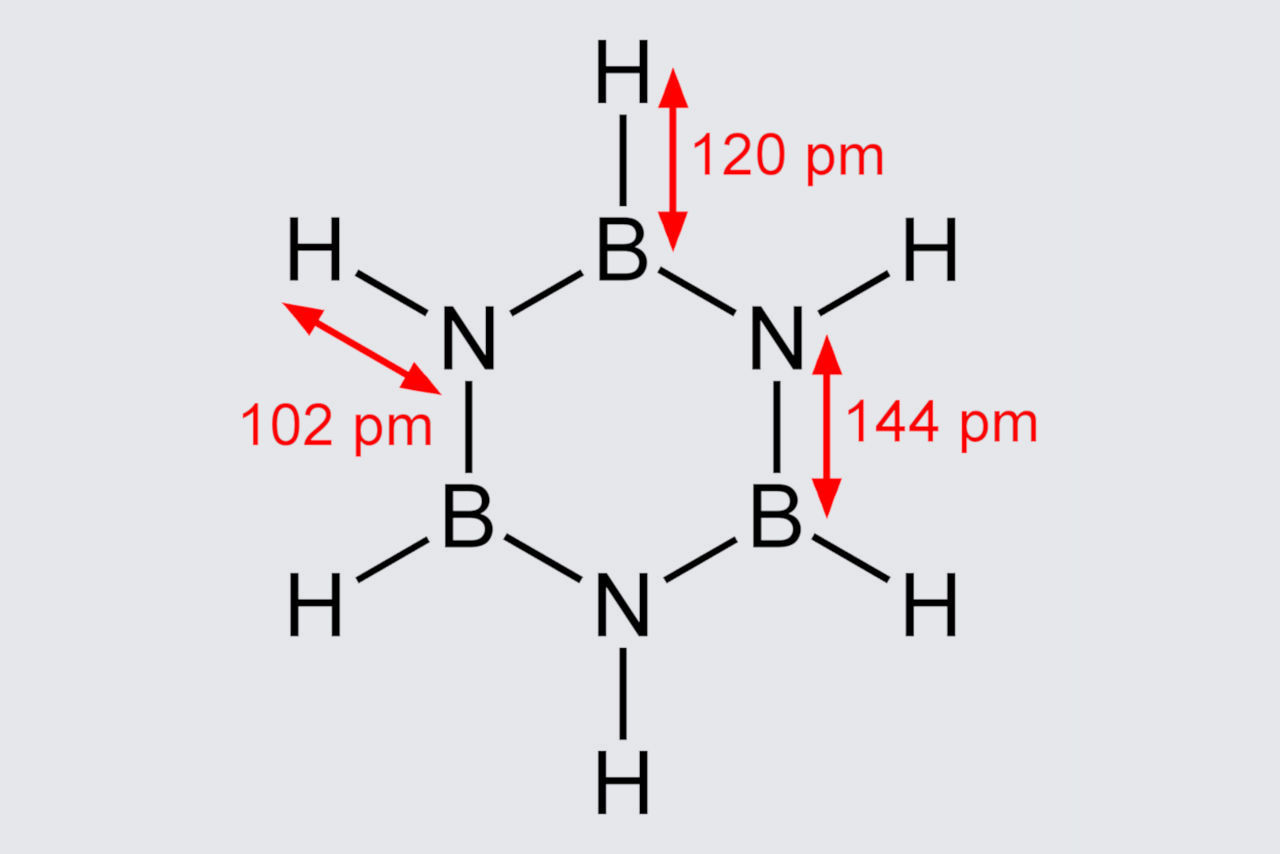
Nach den röntgenkristallographischen Bestimmungen sind die Bindungslängen in der Ringstruktur von Borazin gleich.
Es kann jedoch kein perfektes Sechseck bilden, da die abwechselnde Anordnung von Stickstoff und Bor zu unterschiedlichen Bindungswinkeln und damit zu einer ausgeprägten Molekülsymmetrie führt.
Was ist Benzol?
Benzol ist eine organische Verbindung mit der chemischen Formel C6H6. Es hat eine sechsgliedrige Ringstruktur, bei der alle Glieder Kohlenstoffatome sind. Dabei ist jedes dieser Kohlenstoffatome an ein Wasserstoffatom gebunden.
Da diese Verbindung nur Kohlenstoff- und Wasserstoffatome enthält, ist sie ein Kohlenwasserstoff. Diese Verbindung kommt vor allem in der Natur als Bestandteil von Erdöl vor.
Die molare Masse von Benzol beträgt 78,11 g/mol. Der Schmelz- und Siedepunkt liegt bei 5,53 °C bzw. 80,1 °C. Außerdem ist es bei Raumtemperatur eine farblose Flüssigkeit.
Benzol ist ein aromatischer Kohlenwasserstoff. Folglich hat es einen aromatischen Geruch. Den Röntgenbeugungsuntersuchungen zufolge haben alle Bindungen zwischen den sechs Kohlenstoffatomen ähnliche Längen.
Daher weist es eine Zwischenstruktur auf. Wir bezeichnen es als „Hybridstruktur“, weil nach der Bindungsbildung abwechselnd Einfach- und Doppelbindungen zwischen den Kohlenstoffatomen vorhanden sein sollten.
Die eigentliche Benzolstruktur ist dann das Ergebnis mehrerer Resonanzstrukturen des Benzolmoleküls.
Was sind die Gemeinsamkeiten zwischen Borazin und Benzol?
- Beide sind zyklische Strukturen.
- Beide, Borazin und Benzol, haben einen sechsgliedrigen Ring.
- Außerdem haben beide die gleiche Bindungslänge zwischen den Atomen des Rings.
- Außerdem sind beide bei Raumtemperatur farblose Flüssigkeiten.
- Beide sind auch isoelektronisch.
Was ist der Unterschied zwischen Borazin und Benzol?
Borazin ist eine anorganische Verbindung mit der chemischen Formel B3H6N3, während Benzol eine organische Verbindung mit der chemischen Formel C6H6 ist.
Der Hauptunterschied zwischen Borazin und Benzol besteht also darin, dass Borazin drei Boratome und drei Stickstoffatome in der Ringstruktur enthält, während Benzol sechs Kohlenstoffatome in der Ringstruktur aufweist.
In Borazin sind die Bor- und Stickstoffatome in einem alternierenden Muster angeordnet. Folglich ist das Borazinmolekül kein perfektes Sechseck, während Benzol nur Kohlenstoffatome im Ring hat. Daher kann es ein perfektes Sechseck bilden.
Ein wesentlicher Unterschied zwischen Borazin und Benzol besteht vor allem darin, dass Borazin eine synthetische Verbindung ist, während Benzol als Hauptbestandteil in Erdöl vorkommt.
Ein weiterer Unterschied zwischen Borazin und Benzol besteht auch in ihrer Reaktivität. Im Vergleich dazu ist Borazin reaktiver als Benzol.
Zusammenfassung: Borazin und Benzol
Borazin und Benzol sind isoelektronisch, d. h. sie haben die gleiche Anzahl von Elektronen oder die gleiche elektronische Struktur. Es handelt sich jedoch um zwei verschiedene Verbindungen.
Der Hauptunterschied zwischen Borazin und Benzol besteht darin, dass das Borazin drei Boratome und drei Stickstoffatome in der Ringstruktur enthält, während das Benzol sechs Kohlenstoffatome in der Ringstruktur aufweist.